Diazoacétate d'éthyle
| Diazoacétate d'éthyle | |||

| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | diazoacétate d'éthyle | ||
| Synonymes |
ester éthylique de l'acide diazoacétique, diazoethanoate d'éthyle, DAAE, EDA, éthoxycarbonyldiazométhane |
||
| No CAS | |||
| No ECHA | 100.009.828 | ||
| No CE | 210-810-8 | ||
| PubChem | 638330 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore[1] Huile jaune avec une odeur âcre |
||
| Propriétés chimiques | |||
| Formule | C4H6N2O2 [Isomères] |
||
| Masse molaire[2] | 114,102 6 ± 0,004 6 g/mol C 42,11 %, H 5,3 %, N 24,55 %, O 28,04 %, |
||
| Propriétés physiques | |||
| T° fusion | −22 °C[1],[3] | ||
| T° ébullition | 140-141 °C à 720 mmHg[1],[3] 145 °C[4] 29 à 31 °C à 5 mm[5] |
||
| Solubilité | peu soluble dans l'eau[1] | ||
| Masse volumique | 1,085 g·cm-3 à 25 °C[1],[3] | ||
| Point d’éclair | 47 °C[1] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,46[1],[3] | ||
| Précautions | |||
| SGH[1] | |||
| H226, H302, H315, H351 et P281 |
|||
| Transport[1] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 400 mg/kg (rat, oral)[4] 280 mg/kg (rat, i.v.)[4] |
||
| LogP | (octanol/eau) 1,960[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le diazoacétate d'éthyle est un composé organique de la famille des diazo c'est-à-dire qui porte la fonction −N=N+= éminemment instable. Il est un des rares composés diazo commercialement disponible car la fonction ester le stabilise par délocalisation électronique via le tautomère −O-COEt=CH-N+≡N.
Synthèse
[modifier | modifier le code]La synthèse originale date de 1944 et fut mise au point par Ennis B. Womack et A. B. Nelson. Elle consiste en la réaction du nitrite de sodium NaNO2 sur l'éther éthylique de la glycine hydrochlorée dans une mélange biphasique d'eau et d'éther diéthylique[6].
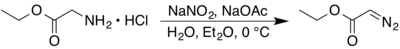
Le rendement de cette synthèse a été légèrement amélioré par N. E. Searle en remplaçant l'éther par du dichlorométhane[5].
Sécurité
[modifier | modifier le code]Le diazoacétate d'éthyl est un produit nocif et inflammable qui explose violemment quand il est chauffé[7].Il est donc absolument nécessaire d'être très prudent en particulier lors des distillations[5].
Notes
[modifier | modifier le code]- Fiche Sigma-Aldrich du composé Ethyl diazoacetatepurum, consultée le 26/09/2016. + fiche MSDS
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Ethyl diazoacetate sur Chemical Book
- (en) « Diazoacétate d'éthyle », sur ChemIDplus.
- N. E. Searle, Ethyl diazoacetate, Organic Syntheses, 1963, Coll. Vol. 4, p.424 - 1956, Vol. 36, p.25. DOI 10.15227/orgsyn.036.0025.
- Ennis B. Womack et A. B. Nelson, Ethyl diazoacetate, Organic Syntheses, 1955, Coll. Vol. 3, p.392 - 1944, Vol. 24, p.56. DOI 10.15227/orgsyn.024.0056.
- ethyl diazoacetate sur LookChem





